
Las reacciones de óxido-reducción se pueden realizar colocando a los reaccionantes en envases separados, unidos tan solo por una conexión eléctrica, que permite el paso de los electrones de un reactivo a otro.
Una celda galvánica es un dispositivo que produce un flujo de electrones a partir de una reacción química espontánea de óxido-reducción.
¿Cómo se lleva a cabo la transferencia?
La transferencia ocurre entre dos semiceldas: una produce electrones con un proceso de oxidación llamado ánodo y la otra los recibe a través del proceso de reducción llamado cátodo.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míLa Celda de Daniell es una típica celda galvánica, utilizada hace 100 años para accionar telégrafos, la cual se fundamenta en la reacción entre el zinc y el cobre:
Ánodo: Zn(s) ↔ Zn+2 + 2e–
Cátodo: Cu+2 + 2e– ↔ Cu0
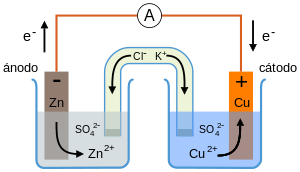
¿Cómo funciona la Celda de Daniell?
En esta celda para producir una corriente eléctrica es importante evitar el contacto directo entre el zinc y el cobre, forzando el flujo de electrones hacia el conductor; debido a esto se mantienen separados, conectados a través del conductor y de un puente salino que permite el paso de los iones, entre las dos medias celdas.
¿Qué es el puente salino?
Es una solución de sal; este puede ser de cloruro de potasio o cloruro de sodio.
Entonces, ya aclarado lo que es el puente salino, seguimos con la línea de explicación. La celda produce un flujo de electrones en el circuito exterior, con una intensidad de corriente idéntica en todos sus puntos. Por lo tanto, el número de electrones generados en la oxidación debe ser igual al número de electrones consumidos en la reducción.
Un mol de zinc genera 2 mol de electrones que los utiliza el ion cúprico (Cu+2) para convertirse en 1 mol de cobre metálico.
Proceso de oxidación
Zn(s) ↔ Zn+2 + 2e–
Proceso de reducción
Cu+2 + 2e– ↔ Cu(s)
Reacción Química Completa
Zn(s) + Cu+2 ↔ Zn+2 + Cu(s)
FUENTE
Rodríguez, María del Pilar. (2006). Química 1. (Segunda edición., pág. 138). Fundación Editorial Salesiana.

