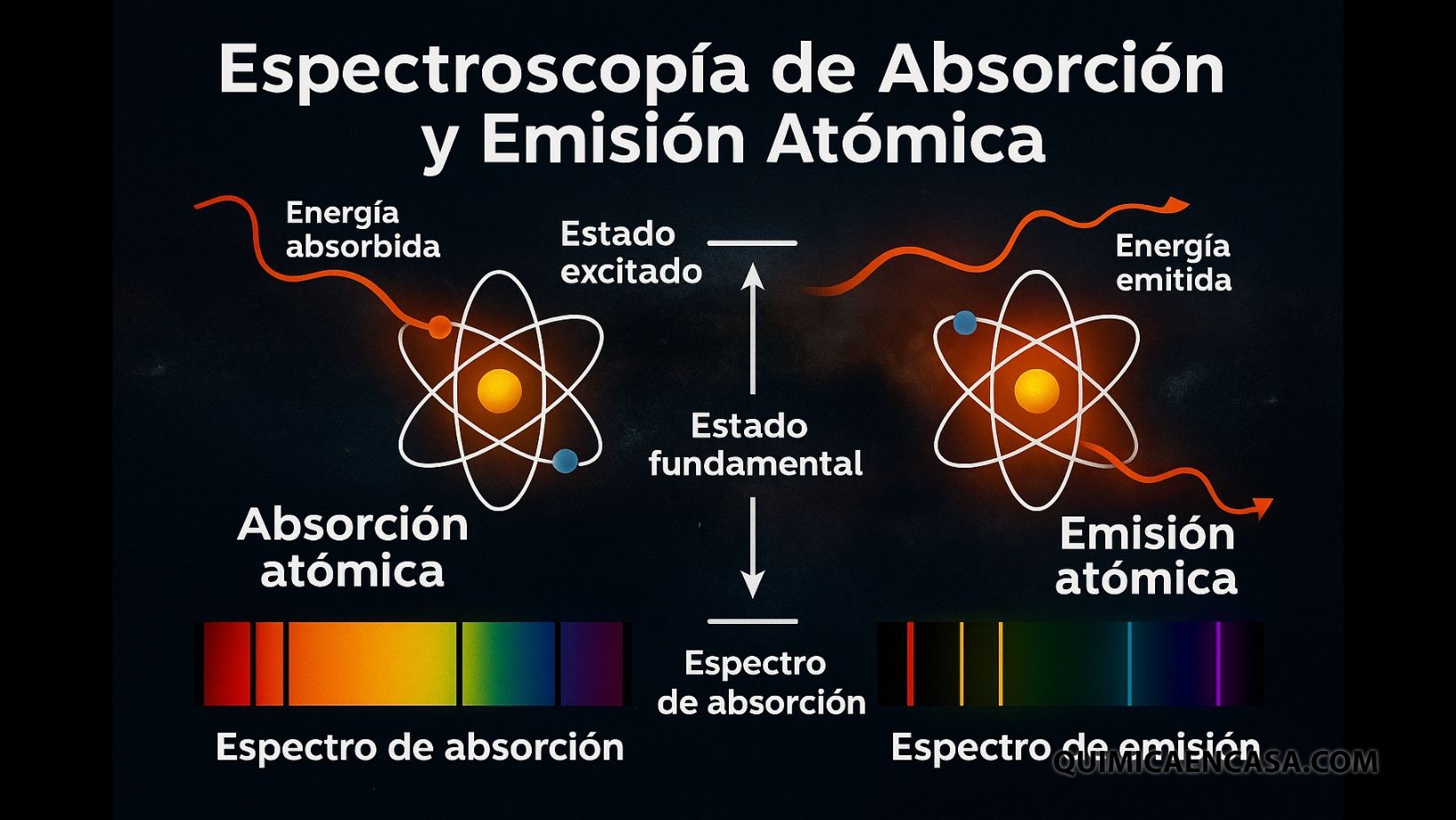
Cada elemento químico tiene una “firma luminosa” única. Cuando un átomo absorbe o emite luz, lo hace en longitudes de onda específicas que funcionan como un código de barras. La espectroscopía de absorción y emisión atómica aprovecha este fenómeno para identificar elementos y medir sus concentraciones con una precisión extraordinaria. Es una técnica fundamental en química analítica, astronomía, medicina y control de calidad industrial.
¿Qué es la espectroscopía atómica?
Es el estudio de cómo los átomos interactúan con la luz.
Dependiendo del proceso, puede ser:
- Absorción atómica: el átomo absorbe energía (luz) y sus electrones saltan a niveles superiores.
- Emisión atómica: el átomo libera energía en forma de luz cuando los electrones regresan a niveles inferiores.
Cada transición electrónica produce o absorbe longitudes de onda específicas, creando un espectro característico.
Espectroscopía de absorción atómica (AAS)
¿Cómo funciona?
- Se atomiza la muestra (generalmente con una llama o un horno de grafito).
- Se ilumina con una fuente de luz que contiene la longitud de onda del elemento a analizar.
- Los átomos absorben parte de esa luz.
- El equipo mide cuánta luz se perdió → esa pérdida es proporcional a la concentración del elemento.
¿Para qué se usa?
- Determinar metales en agua potable (Pb, Cd, Cu).
- Análisis de suelos y fertilizantes.
- Control de calidad en alimentos.
- Toxicología y análisis clínicos.
Espectroscopía de emisión atómica (AES)
¿Cómo funciona?
- La muestra se excita con una fuente de alta energía (llama, plasma, chispa).
- Los electrones suben de nivel y luego regresan.
- Al volver, emiten luz en longitudes de onda específicas.
- El equipo detecta esa luz y la relaciona con la concentración del elemento.
¿Dónde se usa?
- Análisis de minerales y metales.
- Control industrial (aceros, aleaciones).
- Estudios ambientales.
- Astrofísica (identificación de elementos en estrellas).
Absorción vs. Emisión
| Característica | Absorción atómica (AAS) | Emisión atómica (AES) |
| Fuente de energía | Lámpara de cátodo hueco | Llama, plasma, chispa |
| Señal medida | Luz absorbida | Luz emitida |
| Sensibilidad | Muy alta para metales | Alta, especialmente en ICP |
| Aplicaciones | Agua, alimentos, biología | Geología, metalurgia, astronomía |
| Ventaja clave | Precisión y selectividad | Multielemento simultáneo |
Diagrama conceptual
Energía ↑ → electrón sube → absorción
Energía ↓ → electrón baja → emisión
Cada salto electrónico = una línea en el espectro.
¿Por qué cada elemento tiene un espectro único?
Porque cada átomo tiene niveles de energía específicos, determinados por su estructura electrónica.
Esto hace que:
- El sodio emita un amarillo intenso.
- El cobre produzca verde.
- El potasio dé un violeta característico.
Es literalmente un código de barras atómico.
La espectroscopía de absorción y emisión atómica es una de las herramientas más poderosas de la química moderna. Gracias a ella podemos identificar elementos en una muestra, analizar la composición de las estrellas y garantizar la calidad de alimentos, agua y materiales. Cada átomo habla a través de la luz, y estas técnicas nos permiten escuchar su historia.

