Los gases ideales son gases teóricos formados por una serie de partículas precisas y exactas con desplazamiento aleatorio que no interactúan entre sí.

Estos gases no presentan atracción intermolecular lo que permite explicar dicho comportamiento de manera fija mediante las leyes de los gases ideales: Charles, Gay-Lussac y Boyle.
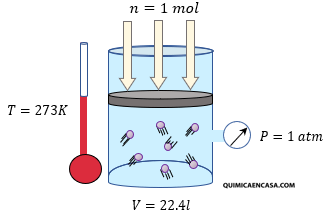
Por su parte, los gases reales presentan un comportamiento más complejo ya que estos sí experimentan interacciones, debido a los cambios de estado que muestran. No obstante, los gases reales pueden presentar un comportamiento ideal cuando son sometidos a condiciones normales de presión (1 atm) y temperatura (273 K).
Ecuación de estado
La ecuación de estado de un gas ideal está establecida bajo una suposición o hipótesis de que las interacciones entre las moléculas de un gas a densidad muy baja son despreciables. Asimismo, en estas condiciones, las moléculas que forman el gas se consideran partículas puntuales. Las leyes de los gases señala que un gas ideal, siempre se encuentran en estado gaseoso.
La ecuación de estado es la siguiente:
P.V = n.R.T
Donde:
P: Presión en atmósfera o mmHg.
V : Volumen en litros
n: número de mol
T: temperatura absoluta (K)
R: constante universal de los gases
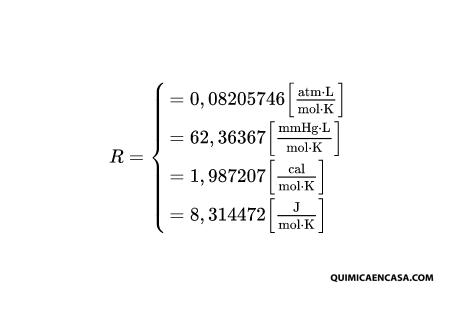
El valor de R más utilizado es el 0,082 atm.L/mol.K. Este valor surge al considerar que 1 mol de cualquier gas ideal y en condiciones normales de temperatura y presión, es decir a una atmósfera y 273 K, ocupa un volumen de 22,413 litros. Por lo tanto si se despeja R en la ecuación de estado queda:
R = P.V / n.T
Si sustituimos queda:
R = 1 atm x 22,413 L / 1 mol x 273 K
R = 0,082 atm.L/mol.K
Características de un gas ideal
Un gas ideal es un modelo matemático útil para representar cómo se comportan los gases reales en ciertas situaciones, como casi todo modelo se basa en excluir algunos obstáculos que puedan dificultar su estudio.
Entonces se considera un gas ideal o hipotético si:
- Está formado por partículas puntuales sin efectos electromagnéticos.
- Las colisiones entre las moléculas y entre las moléculas y las paredes es de tipo elástica, o sea, se conserva el momento y la energía cinética.
- La energía cinética es directamente proporcional a la temperatura.
- Los gases se aproximan a un gas ideal cuando son un gas mono atómico, está a presión y temperatura ambiente.
Ejemplo
- Determine a qué temperatura en ºC se encuentra 10,5 gramos de oxígeno si la presión es de 650 mmHg y ocupa un volumen de 2400 ml.
Datos.
T = ? (ºC)
gramos = 10,5 g O2
P = 650 mmHg
V = 2400 ml
- Primeramente se debe transformar los gramos en mol, el volumen de ml a litros y la presión de mmHg a atm.
Transformación de los gramos de O2 a mol
Se debe hallar la masa molar del O2, el cual es: 2x 16 = 32 g/mol
Entonces se dice que:
1 mol ———— 32 g
X————— 10,5 g
X =0,33 mol de O2
Transformación de ml a litros
1 L ———- 1000 ml
X———— 2400 ml
X = 2,4 Litros
Transformación de mmHg a atm
1 atm ———– 760 mmHg
X —————- 650 mmHg
X = 0,86 atm
- Ahora se debe despejar la ecuación de estado para calcular la temperatura:
P.V = n.R.T
T = P.V / n.R
- Seguidamente se sustituye la fórmula:
T = 0,86 atm x 2,4 L /0,33 mol x 0,082 atm.L/mol.K
T = 2,064 ÷ 0,0271
T = 76,16 K
- Finalmente se transformar la temperatura absoluta (K) a ªC, restando 273:
ºC = K – 273
ºC = 76,16 – 273
ºC = – 196, 84 ºC

