Las estructuras de Lewis son representaciones electrónicas de una molécula, donde se simboliza mediante diferentes signos, que forman parejas, el número de electrones de la capa de valencia de los elementos. Los electrones que se encuentran en zonas comunes a dos átomos son los que forman el enlace químico. Estas estructuras nos dan una idea acerca de los tipos de enlace.

Gilbert Newton Lewis fue un fisicoquímico estadounidense, famoso por su trabajo sobre la denominada «Estructura de Lewis». También es recordado por idear el concepto de enlace covalente y por acuñar el término fotón.

¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míCómo realizar las estructuras de Lewis
Es importante tener conocimiento acerca de la configuración electrónica de los elementos químicos, y para esto es necesario tener a la mano el Diagrama Moeller (método de la lluvia, serrucho, aufbau). Luego que se realice la configuración electrónica de los elementos, se indica los electrones de la capa de valencia (los dos últimos) que son los que nos van a permitir realizar la estructura de Lewis. Estos electrones de valencia los representaremos utilizando algún signo como puntos, equis, asteriscos, entre otros. La representación se irá «llenando» siguiendo un orden específico: primero arriba, luego abajo y finalmente a los lados y así sucesivamente:

Esto bajo la regla del octeto, teoría creada en 1916, por el mismo G. Lewis, donde señala que los iones de los elementos de la tabla periódica presentan la tendencia a completar sus últimos niveles de energía con una cantidad de 8 electrones, de tal forma que adquieren una configuración muy estable. Dicha configuración es igual a la del gas noble (elementos del grupo 18).
Pero como nada enseña tanto como el ejemplo, veamos uno a continuación:
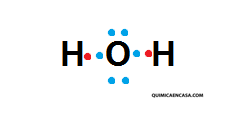
- Si deseo realizar la estructura de Lewis para el agua (H2O), necesito realizar la configuración electrónica del hidrógeno y del oxígeno:
H: z = 1 1s1 electrones de valencia: 1
O: z = 8 1s2 2s2 2p4 electrones de valencia: 6
El átomo de oxígeno: 
El átomo de hidrógeno:
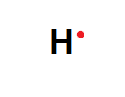
Como el átomo de oxígeno posee dos posibilidades de enlazarse y el hidrógeno solo una, entonces el átomo central será el oxígeno, quedando:
- Otros ejemplos:
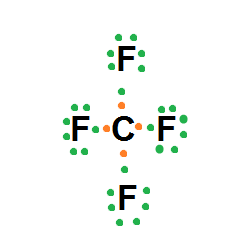
CF4 (tetrafluoruro de carbono)
C: z = 6 1s2 2s2 2p2 e- valencia: 4
F: z = 9 1s2 2s2 2p5 e- valencia: 7
Átomo de carbono:
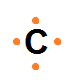
Átomo de flúor:

Como el átomo de carbono posee cuatro posibilidades de enlazarse y el flúor solo una, entonces el átomo central será el carbono, quedando:
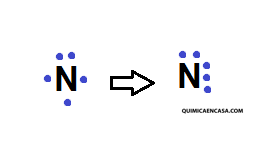
N2 (nitrógeno gaseoso)
N: z= 7 1s2 2s2 sp3 e- valencia: 5
Átomo de nitrógeno:
Se agrupan los electrones que quedan solos, formando así un triple enlace

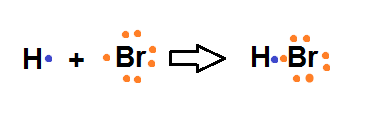
HBr (Ácido bromhídrico)
H: z = 1 1s1
e- valencia: 1
Br: z =35 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
e- Valencia: 7