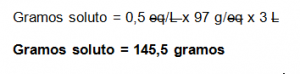En la pasada Guía de Estudios estudiamos las diferencias entre unidades química y unidades físicas de concentración, la definición y formulación de molaridad y resolución de ejercicios. En esta nueva guía de estudios vamos a estar trabajando con la Normalidad.
La Normalidad se define como la cantidad de equivalentes-gramos de soluto entre el volumen de la solución en litros. Se designa con la letra N mayúscula, aunque en la actualidad se le conoce como simplemente concentración equivalentes/Litros o en su abreviatura: eq/L.
El equivalente representa la porción de un compuesto químico cuya masa sustituye o está en capacidad de reaccionar con un átomo de hidrógeno (H+), y dependerá del tipo de sustancia al cual pertenece. Por ejemplo, en el caso del ácido clorhídrico (HCl), cuya masa molecular es 36,6 gramos/mol; su fórmula química contiene un hidrógeno (H+). La masa completa de 36,6 gramos puede ceder un hidrógeno; por lo tanto, esa es la masa que tiene un equivalente del compuesto, es decir ese es el peso equivalente. Ahora bien, para el ácido sulfúrico (H2SO4), que posee una masa molar de 98 gramos/mol y que contiene 2 átomos de hidrógeno en su fórmula, se considera que 49 gramos ceden un H+ y los otros 49 ceden el otro, por tal razón contiene 2 equivalentes cada uno de 49 gramos.
Entonces, podríamos decir que para los ácidos, el cálculo del peso equivalente se realiza dividiendo la masa molecular entre el número de hidrógenos contenidos en su fórmula.
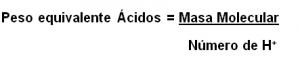
Para los hidróxidos o bases, se realiza el mismo análisis. El peso equivalente será la división entre la masa molecular y el número de radicales oxidrilos (OH–) presentes en la fórmula.
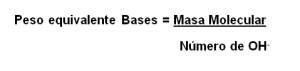 Para las sales, el análisis debe realizarse con el anión presente en la fórmula. Por ejemplo, si tenemos el cloruro de potasio (KCl), el anión presente es el cloruro (Cl–) con capacidad para aceptar un H+ ; por lo tanto, el grupo completo cuya masa es 74,55 gramos/mol, reaccionará con un hidrógeno, lo que indica que su peso equivalente será 74,55 gramos. Pero si tenemos una sal más compleja como el sulfato de aluminio, Al2(SO4)3 con una masa molar de 342 gramos/mol. El anión presente es sulfato (SO42-), y el compuesto contiene 3 sulfatos, cada uno con capacidad para aceptar 2 H+ , la sal completa tiene capacidad para aceptar a 6 hidrógenos (H+), entonces su peso equivalente es el cociente resultante de dividir la masa molecular entre el número de aniones multiplicado por su valencia o carga:
Para las sales, el análisis debe realizarse con el anión presente en la fórmula. Por ejemplo, si tenemos el cloruro de potasio (KCl), el anión presente es el cloruro (Cl–) con capacidad para aceptar un H+ ; por lo tanto, el grupo completo cuya masa es 74,55 gramos/mol, reaccionará con un hidrógeno, lo que indica que su peso equivalente será 74,55 gramos. Pero si tenemos una sal más compleja como el sulfato de aluminio, Al2(SO4)3 con una masa molar de 342 gramos/mol. El anión presente es sulfato (SO42-), y el compuesto contiene 3 sulfatos, cada uno con capacidad para aceptar 2 H+ , la sal completa tiene capacidad para aceptar a 6 hidrógenos (H+), entonces su peso equivalente es el cociente resultante de dividir la masa molecular entre el número de aniones multiplicado por su valencia o carga:


Ejercicios Resueltos
- Determine la concentración en equivalentes por litro (normalidad) de una solución que fue preparada disolviendo 15 gramos de H2SO4 en suficiente agua hasta completar 650 ml de solución.
Datos:
N= ?
g soluto= 15 gramos
V = 650 ml
Masa molar H2SO4 = 98 g/mol
Paso # 1. Cálculo del peso equivalente del soluto H2SO4
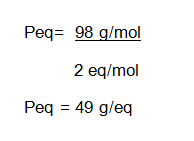
Paso # 2. Transformación del volumen en litros.
 Paso # 3. Cálculo de la Normalidad.
Paso # 3. Cálculo de la Normalidad.
 2. Determine los gramos de soluto que están contenidos en 3000 ml de solución de Ni(ClO2)2 con una concentración de 0,5 eq/L.
2. Determine los gramos de soluto que están contenidos en 3000 ml de solución de Ni(ClO2)2 con una concentración de 0,5 eq/L.
Datos.
gramos soluto= ?
V = 3000 ml
N = 0,5 eq/L
Masa molar Ni(ClO2)2 = 194 g/mol
Paso # 1. Cálculo del peso equivalente del soluto Ni(ClO2)2
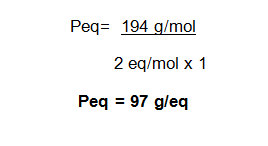 Paso # 2. Transformación del volumen en litros.
Paso # 2. Transformación del volumen en litros.
 Paso # 3. Despejar los gramos de soluto en la fórmula de normalidad
Paso # 3. Despejar los gramos de soluto en la fórmula de normalidad

Paso # 4. Sustituir en la fórmula despejada