Ácido Arrhenius
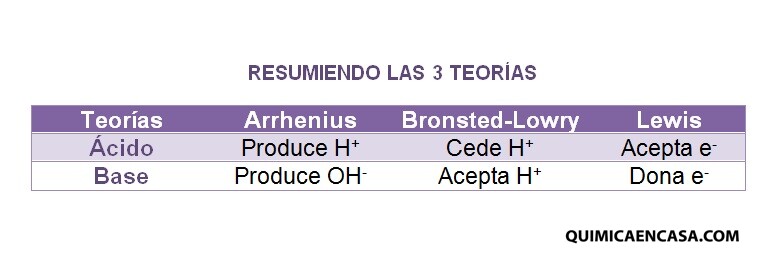
Un ácido es una sustancia que en disolución acuosa produce iones H+:
HA (ac) → H+ (ac) + A− (ac)
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míEl ión H+, se denomina protón y en solución acuosa se encuentra hidratado, situación que en la mayoría de los libros se representa como H3O+. A este ión se le denomina ión hidronio, y se utiliza para indicar que el ión H+, en solución acuosa se encuentra asociado con al menos una molécula de agua, por lo tanto decir iones H+ o protones es equivalente a decir iones hidronio o H3O+.
Base Arrhenius
Una base es una sustancia que en disolución acuosa produce o libera iones OH−:
BOH (ac) → B+ (ac) + OH− (ac)
El anión OH− se denomina ión hidroxilo u oxhidrilo. Este ión está formado por un oxígeno y un hidrógeno con carga eléctrica -1.
Ácido Brønsted–Lowry
Un ácido es una sustancia que cede un protón a otra.
Base Brønsted–Lowry
Una base es una sustancia que capta un protón de otra.
Según la teoría de Brønsted–Lowry , cada reacción ácido-base, produce un ácido y una base que son conjugadas, respectivamente, de la base y el ácido original.
NH3 + H2O → NH4+ + OH−
Base 1- Ácido 2 -Ácido 1-Base 2
En el ejemplo anterior el número indica el par ácido-base conjugado, así la base 1 es la base conjugada del ácido 1 y el ácido 2 es el ácido conjugado de la base 2. Como el agua tiene en su molécula iones H+ e iones OH− puede actuar como ácido o como base dependiendo de la sustancia con la que reaccione.
Ácido Lewis
Un ácido es una sustancia que puede aceptar un par de electrones para formar un enlace.
Base Lewis
Una base es una sustancia que puede aportar un par de electrones para formar un enlace.