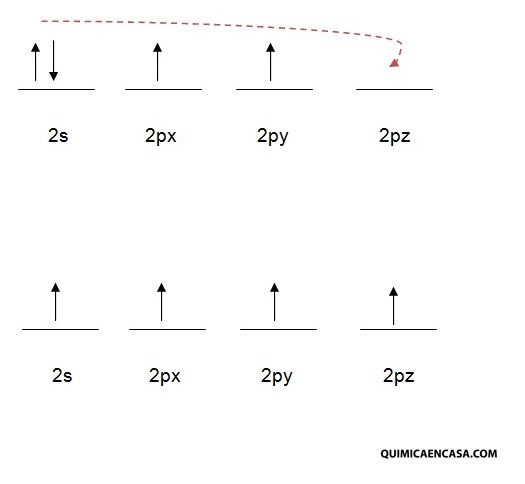
Durante el proceso de formación de un enlace químico, puede suceder que los electrones que se requieren para la obtención de dicho enlace, se hallen constituyendo parejas dentro de los orbitales del elemento al cual corresponden; no obstante, estos pueden desenlazarse y por consiguiente, cambiar de lugar con una cantidad pequeña de absorción de energía, y así de otra manera, se produce la formación de los enlaces necesarios. A dicho proceso se le llama promoción electrónica, que no es más que el paso de un electrón que se halla apareado (emparejado) en un orbital, hacia el orbital más cercano que se encuentre vacío.
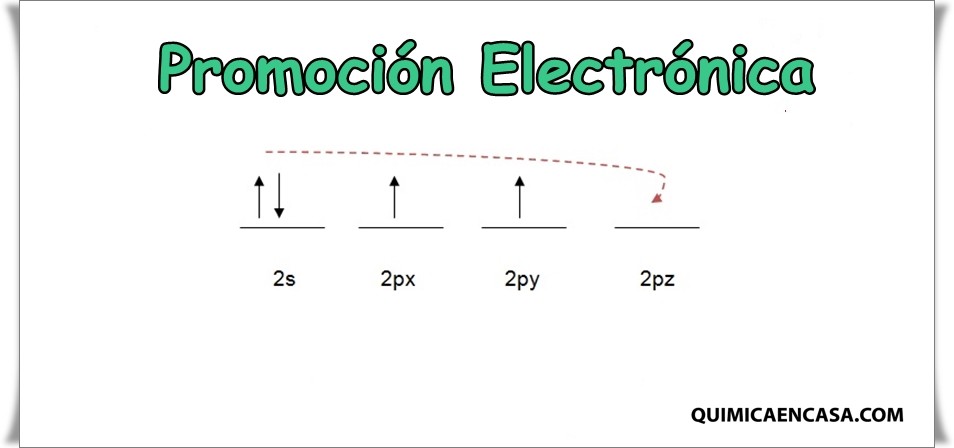
La promoción electrónica tiene su origen en la famosa regla de máxima multiplicidad de Hund, la cual señala que la mayor estabilidad en los orbitales atómicos se obtiene cuando los espines electrónicos se hallan desapareados.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
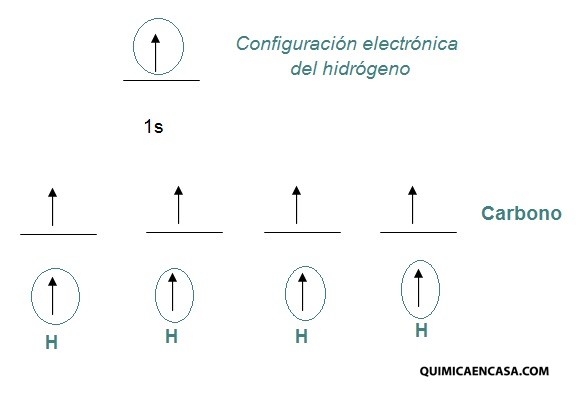
Descubrir planes cerca de míUn ejemplo bastante común se puede observar en la molécula del metano. El metano es un compuesto orgánico cuya fórmula empírica es CH4, si realizamos la distribución electrónica de los elementos carbono e hidrógeno, quedaría de la siguiente forma:
Carbono: Z= 6 1s2 2s2 2p2 electrones de valencia: 4
Hidrógeno: Z=1 1s1 electrones de Valencia: 1
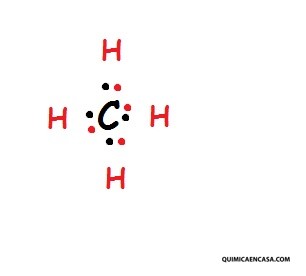
 Como se puede observar, el carbono posee cuatro enlaces covalentes simples, constituidos por uno de sus electrones y el del hidrógeno vecinal. Por lo tanto, es necesario que el átomo de carbono no se quede en su estado fundamental de energía y de esa manera, alcance una promoción electrónica. Estos cuatro electrones desapareados del carbono son indispensables para que se unan a los átomos de hidrógeno, como se observa en la siguiente estructura de Lewis:
Como se puede observar, el carbono posee cuatro enlaces covalentes simples, constituidos por uno de sus electrones y el del hidrógeno vecinal. Por lo tanto, es necesario que el átomo de carbono no se quede en su estado fundamental de energía y de esa manera, alcance una promoción electrónica. Estos cuatro electrones desapareados del carbono son indispensables para que se unan a los átomos de hidrógeno, como se observa en la siguiente estructura de Lewis: