Los números cuánticos determinan la región del espacio-energía de mayor probabilidad de encontrar a un electrón.

Por lo tanto, los números son valores numéricos que indican las características que poseen los electrones de los átomos. Ningún electrón de un mismo átomo puede tener los mismos números cuánticos.
Los números cuánticos se originan en el proceso de la solución de la ecuación de Schrodinger, por las limitaciones de contorno que corresponden utilizar para conseguir la solución que se ajusta al contexto físico. El caso de una partícula confinada en una caja tridimensional, puede ser empleado para mostrar cómo surgen los números cuánticos.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míLa función de onda depende de los valores de tres variables que reciben la denominación de números cuánticos. Cada conjunto de números cuánticos definen una función específica para un electrón.
Son cuatro los números encargados de definir la función de onda (Ѱ) asociada a cada electrón de un átomo: el principal, secundario, magnético y de Spin.
Número cuántico principal
Es un criterio positivo representado por la letra “n”, indica los niveles energéticos principales. Se encuentra relacionado con el tamaño. Cuando su valor aumenta, quiere decir que el nivel ocupa un volumen mayor y puede contener más electrones, y su contenido energético es superior. Sus valores pueden ser desde 1 hasta infinito.
Número cuántico secundario
Este número cuántico viene representado por la letra “l” y nos indica la forma que puede tener el espacio donde se encuentra el electrón. El valor que se le asigna depende del número principal y puede ir desde cero hasta n-1.
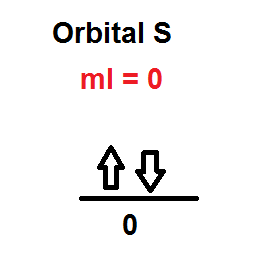
Orbital s —-> l=0
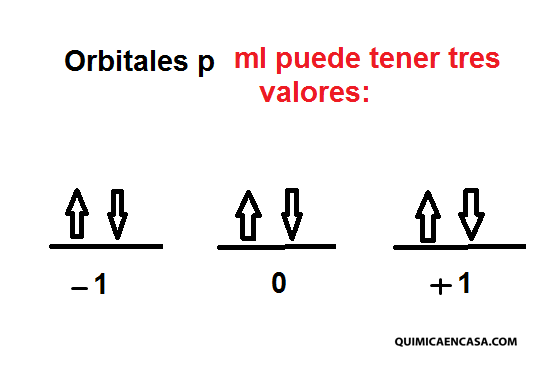
Orbital p —-> l=1
Orbital d —-> l=2
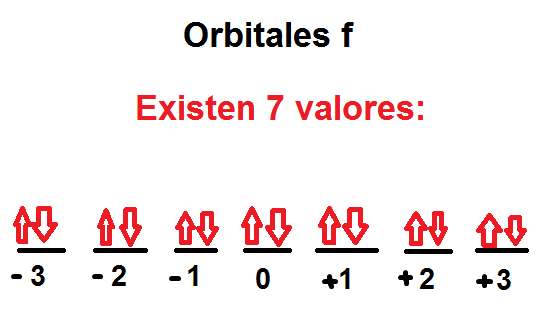
Orbital f —> l=3
Número cuántico magnético
Describe las orientaciones que se pueden asumir los diferentes orbitales frente a un campo magnético. El símbolo utilizado es “m” y también se puede emplear las letras “ml” debido a que los valores que tiene dependen de los valores del número cuántico secundario, que son números enteros que van desde –l hasta +l. El número de valores que puede tener, indica el número de orbitales que puede contener un subnivel de energía.

Número cuántico de Spin
Este número solo presenta dos valores: +1/2 y -1/2, que representan el movimiento del electrón, es decir, la rotación sobre su eje, con dos únicas posibilidades y opuestas entre sí, hacia la derecha o hacia la izquierda. Su símbolo es “ms”.
Ejercicios
- Determine los cuatro números cuánticos para el último electrón en el átomo de potasio.
Primeramente se realiza la distribución electrónica del potasio:
K: Z=19
1s2 2s2 2p6 3s2 3p6 4s1
Entonces como nos piden que encontremos los cuatro números cuánticos del último electrón que es 4S1, trabajaremos en base a dicho valor.
- El número cuántico principal n es igual a 4 porque es el último nivel que alcanza dicho átomo.
- El número cuántico secundario l es igual a cero porque tiene dicho valor cuando el electrón se encuentra en el orbital s.
- El número cuántico magnético ml es igual a cero:
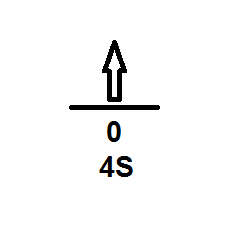
- El número cuántico de Spin ms es +1/2 porque el electrón tiene orientación hacia arriba según la regla de Hund.
Números cuánticos:
n = 4
ℓ = 0
mℓ = 0
ms = +½
- Determine los cuatro números cuánticos para el último electrón en el átomo de cloro.
Cl: Z=17
1s2 2s2 2p6 3s2 3p5
- El número cuántico principal n es igual a 3 porque es el último nivel que alcanza dicho átomo.
- El número cuántico secundario l es igual a 1 porque tiene dicho valor cuando el electrón se encuentra en el orbital s.
- El número cuántico magnético ml es igual a cero:
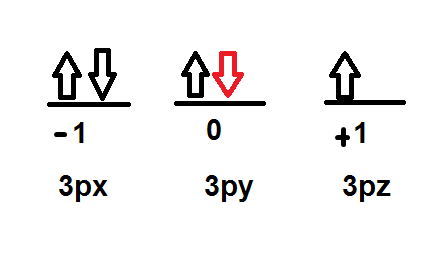
- El número cuántico de Spin ms es -1/2 porque el electrón tiene orientación hacia abajo según la regla de Hund.
Números cuánticos:
n = 3
ℓ = 1
mℓ = 0
ms = -½

