El físico danés Niels Bohr propuso en el año 1913 un nuevo modelo atómico donde pretendía corregir las limitaciones y errores que presentaba el modelo planetario de Rutherford.
Para Bohr el átomo está constituido por una parte central llamada núcleo en la que se localiza la carga positiva y una porción de su masa. Los electrones se encuentran dispuestos en órbitas circulares a través de diferentes niveles alrededor del núcleo. A cada nivel le corresponde una energía que será mayor cuanto más alejada del núcleo se encuentre. La distancia de las órbitas al núcleo, así como su energía, toma valores definidos. Cada nivel admite un número máximo de electrones que es igual a 2n2 donde n designa el nivel de energía (1, 2, 3,…)
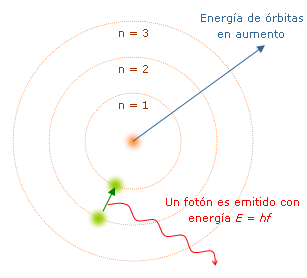
A pesar de que Bohr buscaba mejorar los errores cometidos en la teoría de Rutherford y en parte lo hizo; su teoría también posee ciertas limitaciones. Dentro de las cuales se puede señalar el hecho de que este suponía que todas las órbitas son circulares algo que es totalmente falso. Además, para sus cálculos presume que los electrones tienen una masa infinitamente menor que la de los protones cuando en realidad es solo 1830 veces menor. De igual manera, cree que el núcleo es estático, siendo esto falso ya que este se mueve alrededor de su centro de gravedad.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de mí
