
Para compartir los electrones y así alcanzar un enlace covalente, se genera una superposición de átomos a través de sus orbitales; en el caso de la formación de enlaces con varios elementos, tiene lugar un reordenamiento espacial de los mismos, llamado hibridación. Este proceso es similar a cuando mezclamos, por ejemplo, 1 litro de esmalte blanco con 1 litro de esmalte negro, de la cual obtendremos 2 litros de esmalte de color gris. El color gris posee características de los colores originales, y la cantidad obtenida es igual a la cantidad inicial.
Por tal razón, se dice que la hibridación es un proceso de mezclado de orbitales atómicos diferentes, para producir el mismo número pero de orbitales idénticos entre sí denominados moleculares.
HIBRIDACIÓN sp3
Ahora bien, la hibridación sp3, de lo cual trata esta guía de estudio, es la mezcla de un orbital s y de 3 orbitales p para obtener cuatro orbitales híbridos llamados como “híbridos sp3”, los cuales se ubican de tal manera que forman una estructura tetraédrica con un ángulo de enlace de 109,5º. Las moléculas que poseen hibridación sp3, solo forman enlaces del tipo simple, como por ejemplo: metano, etano, amoniaco, entre otros.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de mí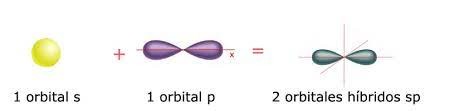
Entonces, la disposición espacial de los orbitales moleculares híbridos dentro de la molécula determina la forma geométrica que presenta la molécula, como se reseña en la siguiente imagen:
ORBITALES ATÓMICOS s y p
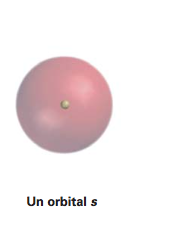
ORBITAL s
El orbital atómico s es de forma circular, es decir, esférico entorno al núcleo atómico. Existe un solo orbital s.
ORBITALES p
Los orbitales p presentan una forma ovalada o de dos esferas aplastadas. Existe tres tipos de orbitales p: px, py, pz, respecto a los ejes X, Y, Z.

HIBRIDACIÓN DEL METANO
- Para realizar la hibridación de la molécula orgánica más simple, es decir la del metano (CH4), primeramente se debe realizar la configuración electrónica de los elementos que forman parte de la molécula, en este caso sería el carbono y el hidrógeno, quedando de la siguiente manera:
C: Z=6 1s2 2s2 2p2 electrones de valencia: 4
H: Z= 1 1s1 electrones de valencia: 1
- Los electrones de valencia nos indican las posibilidades de enlace que presenta los elementos. El carbono posee 4 posibilidades de enlace y el hidrógeno una sola posibilidad, esto quiere decir que para este caso, el carbono es el átomo central de nuestra molécula.
- El siguiente paso es realizar el diagrama de orbitales para el carbono, nuestro átomo central, siguiendo las reglas de Hund, y además realizando la promoción electrónica para obtener la estabilidad en la molécula:
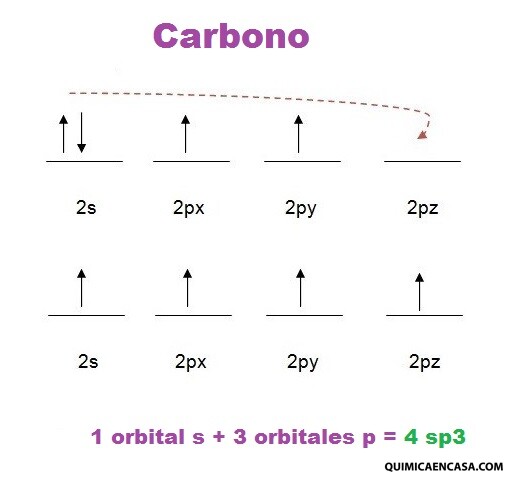
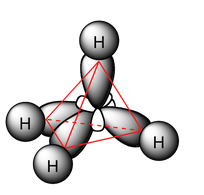
El último paso es efectuar la hibridación de la molécula, con base a lo realizado anteriormente. Si dibujas la estructura de Lewis del metano, tendrás una idea de cómo realizar la hibridación. Primero dibuja 4 orbitales ovalados, que corresponden a los cuatro híbridos sp3, los cuales se disponen formando vértices de un tetraedro. Por consiguiente, dichos híbridos debes solaparlos (unirlos) con el orbital s que presenta cada átomo de hidrógeno, que para el metano, serían 4 átomos. Cuando el solapamiento es frontal, se forman enlaces sigma, que en este caso sería cuatro enlaces sigma.
La estructura final quedaría de la siguiente manera:
Referencias
- Quimitube. (2013). Modelo del enlace de valencia. Hibridación sp3 del carbono en el metano y el etano. Recuperado el 8 de marzo de 2021, de: quimitube.com
- Rodríguez, María del Pilar. (2006). Química 1. (Segunda edición., pág.227). Fundación Editorial Salesiana.

