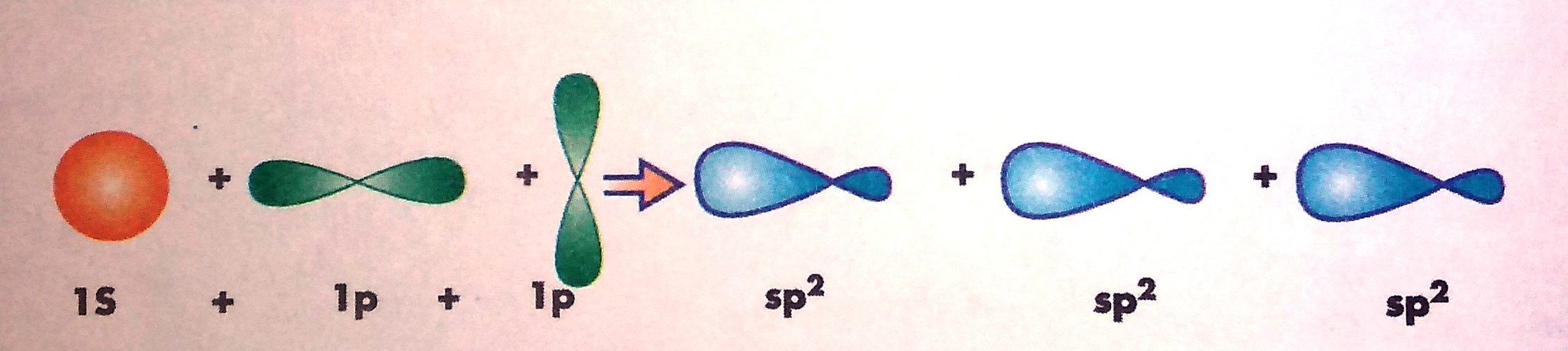
La hibridación sp2 es la mezcla de 1 orbital s y 2 orbitales p, y así obtener tres orbitales híbridos, situados en un plano tridimensional donde se percibe la formación de ángulos de 120º. La geometría característica de este tipo de hibridación es la triangular plana, que puede formar compuestos con enlaces dobles, como el eteno y el dióxido de azufre, entre otros.
Para efectos de este post, explicaremos la hibridación del alqueno lineal más sencillo, el eteno o también llamado etileno.
HIBRIDACIÓN DEL ETENO (CH2=CH2)
Para realizar la hibridación, iniciamos efectuando la configuración electrónica de los elementos que forman parte de la molécula, en este caso sería el carbono y el hidrógeno, quedando de la manera siguiente:
C: Z=6 1s2 2s2 2p2 electrones de valencia: 4
H: Z= 1 1s1 electrones de valencia: 1
Los electrones de valencia nos indican las posibilidades de enlace que presenta los elementos. El carbono posee 4 posibilidades de enlace y el hidrógeno una sola posibilidad, esto quiere decir que para este caso, el carbono es el átomo central de nuestra molécula.
El siguiente paso es realizar el diagrama de orbitales para el carbono, nuestro átomo central, siguiendo las reglas de Hund, y además realizando la promoción electrónica para obtener la estabilidad en la molécula:

Cuando la molécula posee en su estructura algún enlace doble, estamos en presencia de dos tipos de enlaces, uno sigma y otro pi. Los enlaces pi no participan en la hibridación, lo que se ve reflejado en que un orbital p no interviene en la misma, por eso se coloca el spin (flecha) en forma de puntitos. Los enlaces sigma (σ), forman un solapamiento frontal de dos orbitales atómicos que suelen ser diferentes o iguales. No obstante, los enlaces pi (π), se deben al solapamiento lateral de dos orbitales atómicos p sin hibridar.
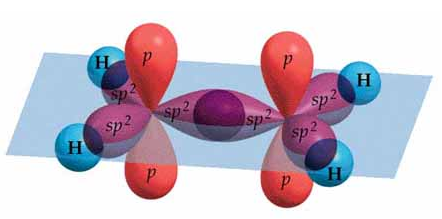
El último paso es realizar la hibridación de la molécula, con base a lo efectuado anteriormente. Si dibujas la estructura de Lewis del eteno, tendrás una idea de cómo realizar la hibridación. Primero dibuja 3 orbitales ovalados, que corresponden a los tres híbridos sp2, los cuales se disponen formando una figura triangular plana. El orbital p que está sin hibridar, debe ser dibujado de manera perpendicular al plano de los orbitales híbridos (uno abajo y otro arriba del plano). Recuerda que estás representando la molécula CH2=CH2, por lo tanto dicha hibridación debe ser representada en cada átomo de carbono del eteno. Finalmente, dichos híbridos debes solaparlos (unirlos) con el orbital s que presenta cada átomo de hidrógeno, que para el eteno, serían 4 átomos. Cuando el solapamiento es frontal, se forman enlaces sigma, que en este caso sería cinco enlaces sigma.
REFERENCIAS
- Quimitube. (2013). Modelo del enlace de valencia. Hibridación sp2 con enlaces dobles carbono-carbono: eteno. Recuperado el 29 de marzo de 2021, de: quimitube.com
- Rodríguez, María del Pilar. (2006). Química 1. (Segunda edición., pág.227). Fundación Editorial Salesiana.

