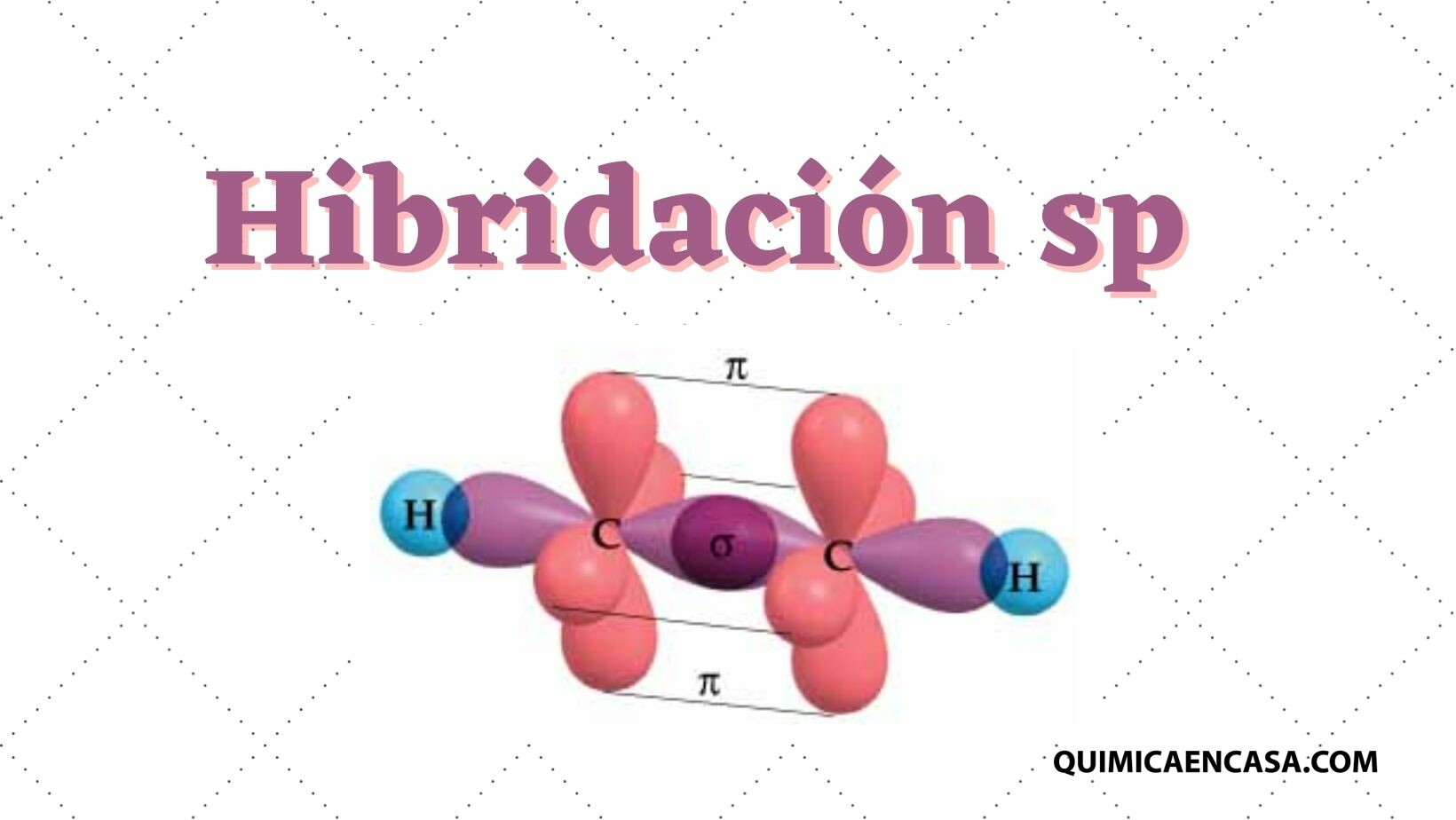
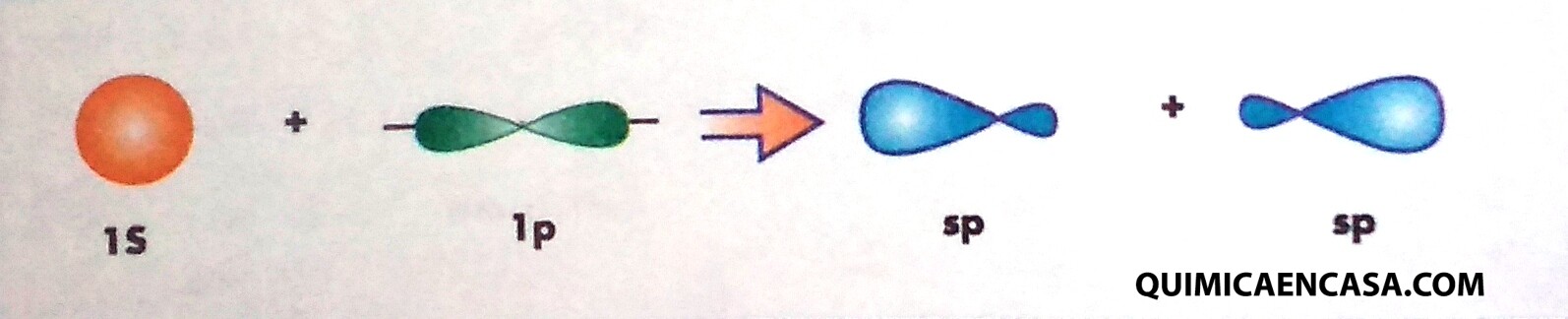
La hibridación sp consiste en la combinación de un orbital atómico s con un orbital p, permitiendo la formación de 2 orbitales sp híbridos, generando una alta repulsión formando ángulos de 180º, dando como resultado una molécula con 2 orbitales p en estado puro y un electrón sin hibridar.
Este tipo de hibridación, al producir enlaces de 180º, toma una forma geométrica del tipo lineal, el cual es común en los compuestos orgánicos alquinos, es decir aquellos que poseen triple enlace carbono-carbono (C≡C). Compuestos como el etino, propino, butino, fluoruro de berilio, entre otros, poseen hibridación sp.
HIBRIDACIÓN DEL ETINO (CH≡CH)
Para realizar la hibridación, iniciamos efectuando la configuración electrónica de los elementos que forman parte de la molécula, en este caso sería el carbono y el hidrógeno, quedando de la manera siguiente:
C: Z=6 1s2 2s2 2p2 electrones de valencia: 4
H: Z= 1 1s1 electrones de valencia: 1
Los electrones de valencia nos indican las posibilidades de enlace que presenta los elementos. El carbono posee 4 posibilidades de enlace y el hidrógeno una sola posibilidad, esto quiere decir que para este caso, el carbono es el átomo central de nuestra molécula.
El siguiente paso es realizar el diagrama de orbitales para el carbono, nuestro átomo central, siguiendo las reglas de Hund, y además realizando la promoción electrónica para obtener la estabilidad en la molécula:
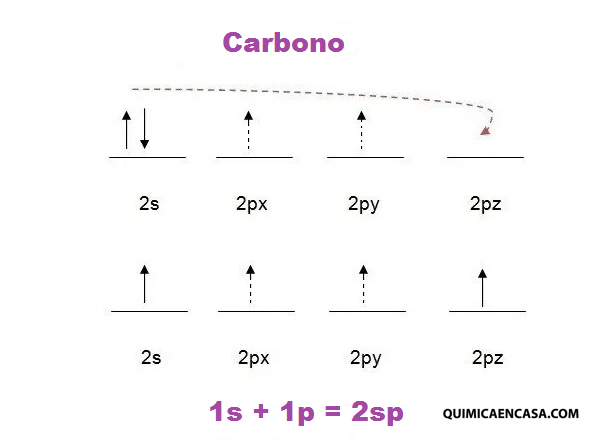
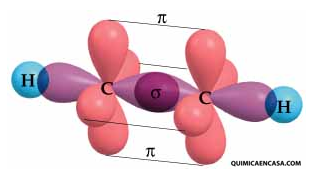
Cuando la molécula posee en su estructura algún enlace triple, estamos en presencia de tres enlaces, uno sigma y dos pi. Los enlaces pi no participan en la hibridación, lo que se ve reflejado en que dos orbitales p no interviene en la misma, por eso se coloca el spin (flecha) en forma de puntitos. Los enlaces sigma (σ), forman un solapamiento frontal de dos orbitales atómicos que suelen ser diferentes o iguales. No obstante, los enlaces pi (π), se deben al solapamiento lateral de dos orbitales atómicos p sin hibridar.
El último paso es realizar la hibridación de la molécula, con base a lo efectuado anteriormente. Si dibujas la estructura de Lewis del etino, tendrás una idea de cómo realizar la hibridación. Primero dibuja 2 orbitales ovalados, que corresponden a los dos híbridos sp, los cuales se disponen formando una figura lineal. Los orbitales p que están sin hibridar, deben ser dibujados de manera perpendicular al plano de los orbitales híbridos (uno abajo y otro arriba del plano). Recuerda que estás representando la molécula CH≡CH, por lo tanto dicha hibridación debe ser simbolizada en cada átomo de carbono del etino. Finalmente, dichos híbridos debes solaparlos (unirlos) con el orbital s que presenta cada átomo de hidrógeno, que para el etino, serían 2 átomos. Cuando el solapamiento es frontal, se forman enlaces sigma, que en este caso sería tres enlaces sigma.
REFERENCIAS
- Quimitube. (2013). Modelo del enlace de valencia. Hibridación sp con enlaces triples carbono-carbono: etino. Recuperado el 08 de abril de 2021, de: quimitube.com
- Rodríguez, María del Pilar. (2006). Química 1. (Segunda edición., pág.227). Fundación Editorial Salesiana.

