Un enlace químico es el acercamiento de dos átomos interactuando químicamente para producir una molécula.

Por su parte, la entalpía de enlace se define como la cantidad de energía que hay que suministrar a un par de átomos para romper la interacción química presente entre ellos. Su valor es característico para cada tipo de reacción.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míPor ejemplo, la entalpía de enlace de una unión carbono – hidrógeno es de 413 KJ/mol y la entalpia de enlace de la unión oxígeno – hidrógeno es de 463 KJ/mol. Esto quiere decir que para romper el enlace O-H se requiere mayor energía que para romper un enlace C-H. Es decir, en la medida que la fuerza de los enlaces sea mayor, la entalpía también lo será. Si es necesario suministrar energía para romper un enlace, entonces se debe desprender energía al formarse. En ambos procesos se involucra la misma cantidad de energía.
De manera resumida se puede decir que:
- si los enlaces que se rompen son débiles y los formados son fuertes, la reacción es exotérmica.
- si los enlaces que se rompen son fuertes y los formados son débiles, la reacción es endotérmica.
Ejemplo:
- A partir de las entalpías de enlace. Calcule la variación de entalpía de la siguiente reacción química:
CH3Br → C + 3H + Br
Entalpías de enlace:
H C-H = 413KJ/mol
H C-Br= 276 KJ/mol
La variación de entalpía de enlace se calcula mediante la siguiente reacción:
ΔH = ∑enlaces rotos – ∑enlaces formados
Los enlaces rotos están ubicados en los reactantes y los enlaces formados en los productos. Si observamos la reacción química anterior, notaremos que hay un solo reactante del cual se derivan 4 enlaces rotos: 3 enlaces carbono-hidrógeno y un enlace carbono-bromo. Por su parte, hay 3 productos: carbono, hidrógeno y bromo, pero no hay ningún enlace formado.
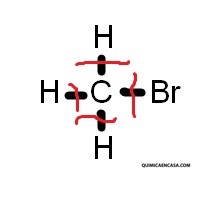
Matemáticamente se expresaría así:
ΔH = ∑enlaces rotos – ∑enlaces formados
ΔH = 〈3 enlaces C-H x entalpía de dicho enlace + 1 enlace C-Br x entalpía de dicho enlace 〉 – 0 (no hay ningún enlace formado)
ΔH = 3. (413KJ/mol) + 1. (276 KJ/mol)
ΔH = 1239KJ/mol + 276 KJ/mol
ΔH =1515 KJ/mol
ΔH > 0 por lo tanto es una reacción endotérmica.

