Descubre cómo las reacciones químicas encuentran su propio balance

¿Por qué un refresco pierde gas?
Cuando abres una botella de refresco, el gas escapa. Pero si la cierras, parte del gas vuelve a disolverse. Este fenómeno es un ejemplo cotidiano de equilibrio químico, un concepto fascinante que explica cómo las reacciones se ajustan solas para mantener estabilidad.
¿Qué es el equilibrio químico?
Es el punto en una reacción reversible donde la velocidad de la reacción directa (formación de productos) es igual a la velocidad de la reacción inversa (reformación de reactivos). No significa que las cantidades sean iguales, sino que no cambian con el tiempo.
- Ejemplo clásico:
N2 + 3H2 →2NH3
(Síntesis del amoníaco – proceso de Haber)
La constante de equilibrio (Kc)
La constante de equilibrio indica cuánto producto se forma en una reacción. Se calcula con las concentraciones de reactivos y productos:
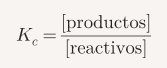
- Si Kc > 1, se favorecen los productos.
- Si Kc < 1, se favorecen los reactivos.
Ejemplos cotidianos de equilibrio químico
| Situación | Reacción | Tipo de equilibrio |
| Refrescos con gas | CO₂ disuelto ↔ CO₂ gaseoso | Físico |
| Perfumes | Evaporación ↔ condensación de compuestos volátiles | Físico-químico |
| Sangre y oxígeno | Hb + O₂ ↔ HbO₂ | Biológico |
| Industria química | Síntesis de amoníaco, ácido sulfúrico | Industrial |
Principio de Le Chatelier: ¿qué pasa si alteramos el equilibrio?
Este principio dice que si se modifica una condición del sistema, el equilibrio se ajusta para contrarrestar el cambio.
- Aumentar la concentración de reactivos: favorece la formación de productos.
- Aumentar la temperatura: favorece la reacción endotérmica.
- Aumentar la presión: favorece el lado con menos moléculas de gas.
Ejemplo visual: si empujas un columpio, se ajusta para volver al centro. Así funciona el equilibrio químico.
El equilibrio es una danza molecular
El equilibrio químico no es estático, es dinámico. Las moléculas van y vienen, buscando balance. Entender este concepto te permite ver la química como un sistema inteligente, capaz de adaptarse y responder.
Fuentes
- Khan Academy – Equilibrio químico
- Chemistry LibreTexts – Chemical Equilibrium
- BBC Bitesize – Reversible reactions and equilibrium

