El científico Rutherford fue el primero en considerar que el átomo está divido en dos áreas. Rutherford realizó en el año 1911 el «experimento de la lámina de oro», que da explicación a esta teoría.
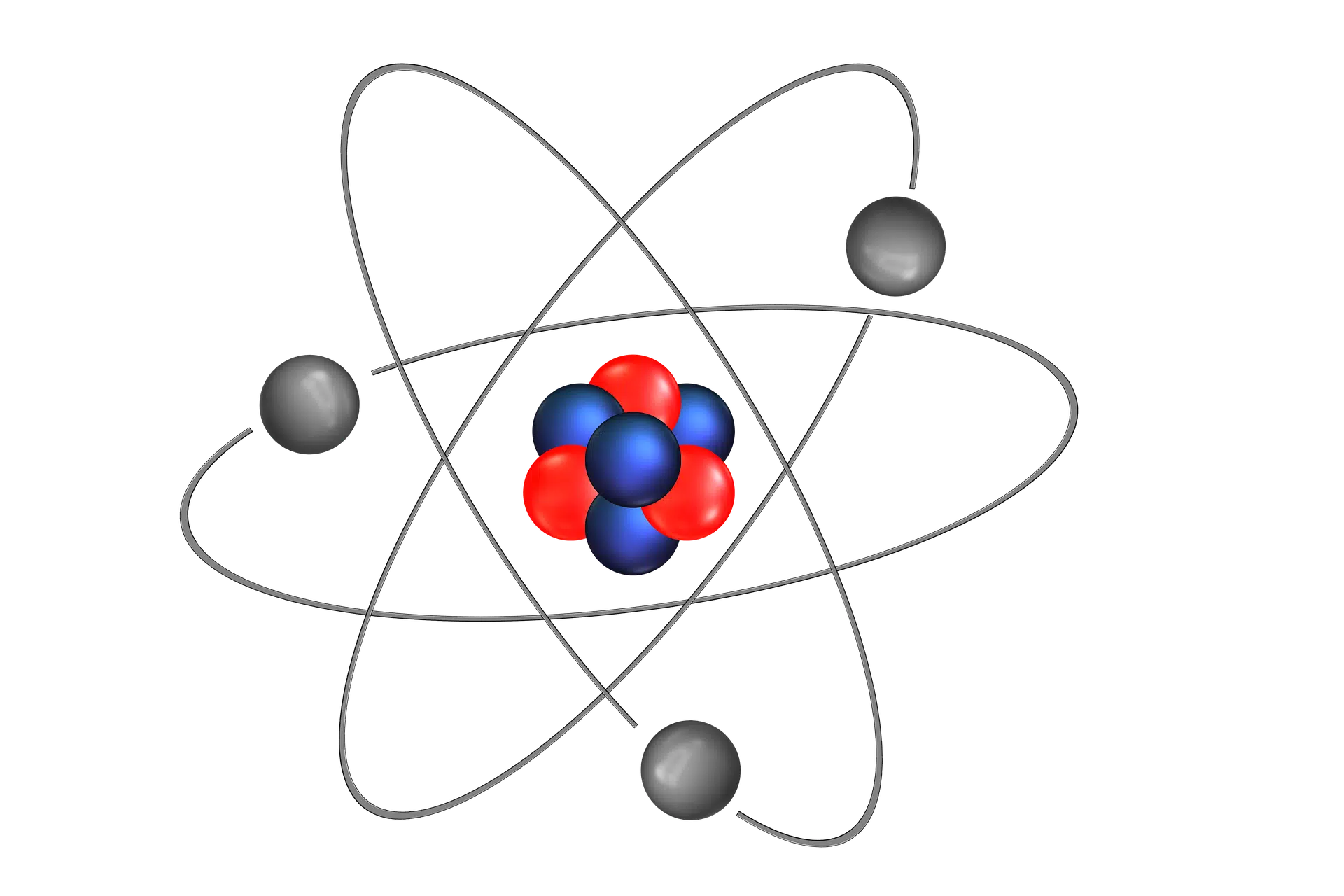
A pesar de que el modelo planetario de Rutherford es el más utilizado hoy en día, posee ciertas insuficiencias. Por ejemplo, una de ellas es que refutaba las leyes del electromagnetismo de Maxwell, que estaban perfectamente demostradas mediante cuantiosos fundamentos teóricos y experimentales. Las leyes de Maxwell, señalan que una carga eléctrica en movimiento, como el electrón, debería emitir energía consecutivamente en forma de radiación, con lo que llegaría un momento en que el electrón caería sobre el núcleo y la materia se destruiría en un tiempo bastante breve, lo que haría considerar que este modelo no es estable.

