Todo lo que nos rodea está formado por átomos, aunque no podamos verlos y conocer con certeza la forma que estos presentan. Esta inquietud ha permitido que científicos diseñaran y propusieran modelos que lograran explicar la estructura del átomo.
El modelo del átomo nuclear es uno de ellos, siendo el de mayor utilidad, ya que acabó con el mito de que el átomo era la menor partícula indivisible constituyente de la materia.
Los átomos presentan la misma estructura donde los electrones giran alrededor del núcleo. De igual manera, existen tantos tipos de átomos como de sustancias elementales. Los elementos poseen un número específico de protones en su núcleo. Por ejemplo, el átomo de hidrógeno, el cual es el más sencillo, presenta en su núcleo tan solo un protón y gira a su alrededor un electrón. Sin embargo, el átomo de uranio posee 92 protones, 146 neutrones y 92 electrones que giran alrededor de su núcleo.
Núcleo del átomo
El núcleo es la parte central del átomo, el cual posee un diámetro entre 10-13 cm aproximadamente y carga eléctrica positiva. Además tiene una densidad de unos 40 millones de toneladas por cm3.
Ernest Rutherford fue el primer científico que comprobó en el año 1911 la existencia del núcleo y sus dimensiones finitas.
Partículas que constituyen el átomo
Protones
Son aquellas partículas elementales que exhiben una carga eléctrica positiva y una unidad de masa 1850 veces más grande que el electrón. Los protones forman parte de todos los núcleos de los diferentes átomos que forman las sustancias.
Neutrones
Son aquellas partículas elementales que no muestran carga eléctrica, por lo que son consideradas neutras. Presentan una unidad de masa parecida a la del protón.
- Número atómico
El número atómico es el número total de protones presentes en el núcleo. Es considerada una propiedad invariable de los átomos de cada elemento. Se le simboliza con la letra Z.
- Número másico o masa atómica
La masa atómica es la suma del número de protones y neutrones de cada elemento. Se le simboliza con la letra A.
- Número de neutrones.
Se le simboliza con la letra N y se calcula restando el número másico con el número atómico.
N = A – Z

Por ejemplo:

Br: Bromo
Número másico o masa atómica: 80
Número atómico o número de protones: 35
Número de neutrones: N = 80 – 35 = 45 neutrones
Por lo tanto, los neutrones son las partículas responsables de que los átomos de un mismo elemento presente diferente masa atómica, o sea son responsables de la existencia de los isótopos.
Electrones
Son aquellas partículas elementales que se encuentran girando alrededor del núcleo y poseen carga eléctrica negativa. Presentan una masa 1840 veces menor que la del protón y la del neutrón.
- Capa de electrones
El volumen de los átomos viene representado por los electrones que se hallan describiendo órbitas alrededor del núcleo. De hecho no todos los electrones poseen el mismo nivel de energía y no describen las mismas órbitas. Entonces debido a la dificultad que se presenta a la hora de determinar con exactitud la velocidad y la posición del electrón en los átomos, los científicos han elaborado modelos matemáticos. Estos modelos están constituidos por las capas de electrones. Dichas capas son ciertas regiones energético-espaciales donde existe mayor probabilidad de encontrar los electrones.
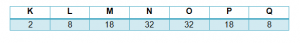
Para representar cada nivel que posee la capa de electrones, se utiliza las letras K, L, M, N, O, P, Q; donde la primera capa K es la más cercana al núcleo del átomo y por lo tanto, posee el nivel energético más bajo. La última capa es representada por la letra Q que al estar más lejos del núcleo del átomo, exhibe el mayor nivel de energía.
Por ejemplo tenemos el átomo de flúor:
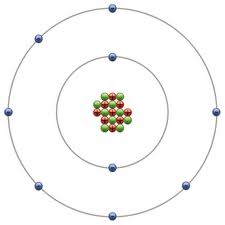
F: Z= 9; K: 2, L: 7
Ahora para el átomo de cloro: