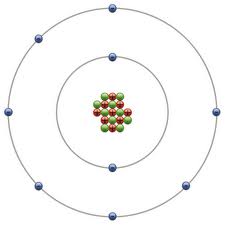
Una característica principal de los ácidos débiles es que no se disocian completamente en una disolución acuosa. Este tipo de ácidos aporta iones hidrógenos positivos al medio, igualmente de poseer la capacidad de aceptarlos.

En una disolución acuosa, el ácido fluorhídrico (HF) estará sin disociar, entre tanto el resto del ácido se disociará en iones hidrógenos positivos (H+) y el anión flúor (F–), creando un equilibrio ácido-base que se puede observar en la siguiente ecuación química:
HF ⇌ H++F–
De todos los ácidos halogenados el ácido fluorhídrico es el más débil, este hecho se puede explicar mediante el análisis de los siguientes factores:
La fuerza de enlace del ácido fluorhídrico es sumamente mayor que los enlaces que forman los ácidos de sus respectivos compañeros de grupo, lo cual indica que el enlace H-F es más difícil de romper que los enlaces H-Cl, H-Br y H-I.
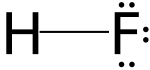
El orden de la fuerza de enlace de los ácidos halogenados, es el siguiente:
HF > HCl > HBr > HI
Tamaño del ion flúor
El ion pequeño de gran carga que presenta el flúor, que se origina cuando se ioniza el ácido fluorhídrico, permite que acreciente el ordenamiento de las moléculas de agua. Este aumento es perjudicial en el proceso de ionización.